- فروش مواد شیمیایی
- مواد اولیه صنایع غذایی
- فروش ظروف آزمایشگاهی
- فروش تجهیزات
- مطالب مفید
- آگهی رایگان
- پیشنهادهای ویژه
- آموزش کار با سایت
- ورود به حساب کاربری
زمانی که اسید ضعیف و نمک آن یا باز ضعیف و نمک آن با هم مخلوط شوند، محلول بافر به وجود میآید که اصطلاحا به آن بافر گفته میشود. مهمترین خصوصیت محلولهای بافر این است که در صورت اضافه شدن مقدار کمی اسید یا باز قوی، PH محلول تغییری نمیکند. به عبارت دیگر میتوان گفت دارای توانایی حفظ PH محلول میباشند. محلول بافر اسیدی دارای PH کمتر از 7 و بافر بازی دارای PH بیشتر از 7 میباشد. به طور کلی برای جلوگیری از تغییرات PH یک محلول، بدون در نظر گرفتن نوع حلشونده، از محلولهای بافر استفاده میشود.
نمونهای از محلول بافر که شامل اسید ضعیف و نمک آن میباشد عبارت است از محلولی از استیک اسید (CH3COOH) و سدیم استات (CH3COONa) که مکانیزم واکنشها در تصویر زیر آمده است.
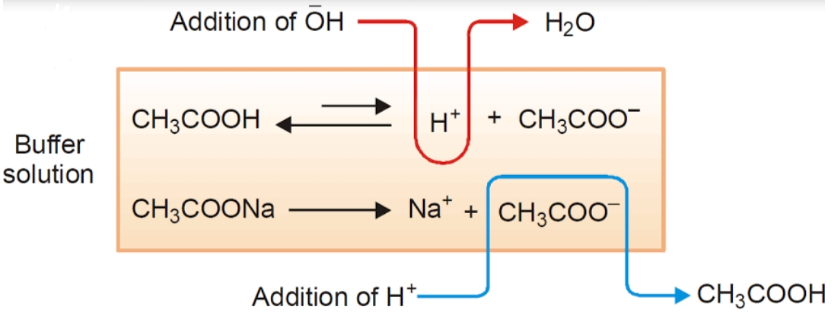
وجود تعادل بین اسید HA و باز مزدوج آن A– در محلول بافر باعث مقاوم بودن آنها نسبت به تغییرات pH میشود. واکنش تعادلی در محلول بافر به صورت زیر است:
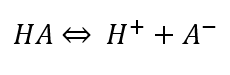
ثابت تعادل میتواند قدرت یک اسید ضعیف را نشان دهد. ثابت تعادل تفکیک اسید Kα، نشاندهنده تمایل یک اسید برای تفکیک شدن در یک واکنش است:
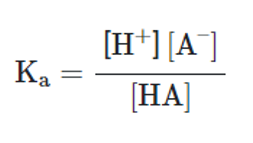
هرچقدر در معادله بالا صورت کسر بزرگتر باشد، نشاندهنده تمایل واکنش به تشکیل H+ بیشتر و کاهش میزان PH محلول است.
همانطور که میدانیم، بافر، محلول تعادلی اسید ضعیف و باز مزدوج آن است. زمانی که مقداری اسید قوی H+ به محلول اضافه شود، بر اساس اصل لوشاتلیه، تعادل به سمت چپ پیشروی میکند. این اتفاق باعث جلوگیری از تغییرات زیاد غلظت یون هیدروژن H+ میشود. از طرف دیگر، در صورت اضافه شدن باز قوی به محلول، میزان کاهش یون هیدروژن، از مقدار قابل انتظار کمتر میشود.
محلولهای بافر، برای ثابت نگهداشتن PH محلول دارای ظرفیت مشخص هستند. در صورت اضافه کردن مقدار زیادی اسید یا باز به محلول، قابلیت کنترل PH محلول از بین خواهد رفت. بنابراین ظرفیت بافر را میتوان این گونه تعریف کرد که میزان مشخصی از اسید و باز را میتوان به حجم مشخصی از محلول بافر اضافه کرد تا قبل از این که PH محلول تغییر محسوسی داشته باشد. نکنه قابل توجه این است که ظرفیت یک محلول بافر وابسته به مقدار اسید ضعیف و باز مزدوج آن میباشد.
برای تولید محلولهای بافر از 3 روش استفاده میشود.
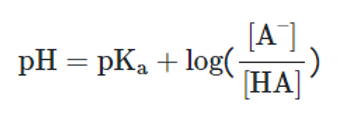
pH: غلظت یون هیدروژن [H+]
pKα: ثابت تفکیک اسید
[A-] و [HA]: غلظتهای باز مزدوج و اسید
برای انتخاب محلول بافر مناسب، باید 2 قانون را مد نظر قرار داد:
معمولا عمر محلولهای تجاری حدود 2 سال میباشد ولی اگر ظرف محلول باز شود، مدت زمان استفاده آن به 3 الی 6 ماه کاهش مییابد. بافرهای قلیایی که PH بیشتر از 10 دارند به دلیل تغییر در اثر تماس با دی اکسید کربن (CO2)، زمان نگهداری محدودتر (در حد 1 ماه) دارند. به طور کلی بهتر است محلولهای بافر را در بطری یا بالونهای مخصوص و یا ظروف مخصوص پلاستیکی، در دمای 15 الی 25 درجه سانتیگراد نگهداری شوند.
از کاربردهای اصلی محلولهای بافر، کنترل PH آنزیمها در ارگانیسمهای مختلف میباشد. عملکرد تعدادی از آنزیمها فقط در شرایط خاص PH صورت میگیرد، بنابراین در صورت تغییر PH محلول، امکان کاهش سرعت عملکرد آنزیمها و یا توقف کامل آنها وجود دارد. گاهی اوقات این مورد باعث میشود که آنزیمها به طور کامل فعالیت کاتالیزوری خود را از دست بدهند. معروفترین نوع محلول بافر، خون میباشد. در پلاسمای خون بافر کربنیک اسید (H2CO3) و بیکربنات (HCO3–) وجود دارد که PH خون را بین 7.45-7.35 حفظ میکند. استفاده دیگر آن در بیولوژی است. برای تنظیم عملکرد پروتئینها و حفظ PH محلول از محلولهای بافر استفاده میشود. اگر مقدار PH از محدوده موردنظر پروتئین خارج شود، پروتئین میشکند و عملکرد آن متوقف خواهد شد.
محلولهای بافر در صنعت نیز استفاده میشوند. از جمله فرآیندهای تخمیری و صنعت نساجی که باعث کمک به تنظیم شرایط مناسب برای رنگهای مورد استفاده در الیاف میشوند. کاربرد دیگر آنها در آنالیزهای شیمیایی و کالیبره کردن PHسنجها میباشد. همچنین میتوان در آبکاری، تهیه چرم، مواد عکاسی و رنگها از محلولهای بافر بهره برد.
در ویدئو زیر توضیحات بیشتری درباره نحوه عملکرد محلول های بافری داده شده است:
استخراج طلا از فلزات اگر کمی با استخراج طلا آشنا باشید می دانید که امروزه استخراج طلا از قطعات الکترونیکی، برد های کامپیوتری، لامپ و … امکان پذیر است. اولین سوالی که به ذهن ما می رسد این است که چرا در تمامی دوران ها استخراج طلا مورد توجه بوده است ؟ طلا فلزی زرد […]
گوش انسان یکی از اعضای پراهمیت بدن انسان است که وظیفه حس شنوایی را بر عهده دارد. گوش انسان قادر است تا صداهای مختلف در محدوده فرکانس 20 تا 20هزار را بشنود. در این مقاله به طور خلاصه آناتومی گوش شرح داده شده است. گوش انسان شامل سه بخش گوش خارجی، گوش میانی و گوش […]
استخراج فلزات یکی از موضوعات بسیار مهم و مورد توجه به حساب میآید. یکی از روشهای استخراج فلزات که در بین فلزات گرانبها محبوبتر است، روش لیچینگ (هیدرومتالورژی) میباشد. وقتی فلزات در آب یا اسید قرار میگیرند، واکنش تولید گاز هیدروژن انجام شده و اتم های فلز به یونهای آن تبدیل میشوند. اما هر اسیدی […]
بشر بشر یکی از پرکاربردترین ظروف آزمایشگاهی می باشد. این ظروف استوانه ای شکل کف تخت بوده و عموما دارای لبه ای کوچک در دهانه ی خود به جهت راحت ریختن مایعات می باشند. خرید بشر انواع بشر بشرها از لحاظ ساختاری و شکل ظاهری و استفاده متداول به سه دسته تقسیم می شوند. بشرهای […]