- فروش مواد شیمیایی
- مواد اولیه صنایع غذایی
- فروش ظروف آزمایشگاهی
- فروش تجهیزات
- مطالب مفید
- آگهی رایگان
- پیشنهادهای ویژه
- آموزش کار با سایت
- ورود به حساب کاربری
اسید نیتریک یا جوهر شوره یکی از مواد بسیار پرکاربرد در صنعت است که برای شست و شو، استفاده فراوانی دارد. در مقاله پیش رو به معرفی این ماده، خواص، کاربردها و موارد ایمنی کار با آن پرداخته شده است.
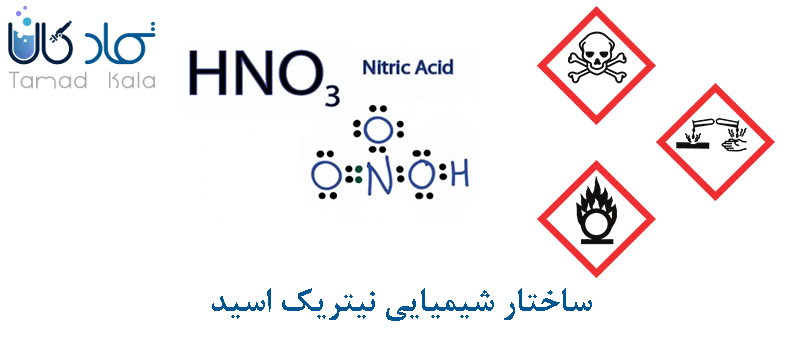
اسید نیتریک دارای نامهای دیگری مانند نیتریک اسید، جوهر شوره، اسید ازته، نیترات هیدروژن، اسید ازوتیک و ازوتیک اسید است. فرمول شیمیایی آن HNO3 است. مادهای زرد یا بیرنگ است. اسید نیتریک دارای بویی زننده و تند است. نقطه ذوب آن، 41- درجه سانتی گراد و نقطه جوش آن، 122 درجه سانتی گراد است. این ماده کاملا قابل حل در آب بوده و غیر قابل اشتعال است. نمونه پودری این ماده معمولا دارای دو نوع تک آبه و 3 آبه است. جرم مولی این ماده 63 گرم بر مول است.
اسید نیتریک یک ماده به شدت اکسنده است و تاریخچه استفاده از آن، به استخراج طلا باز میگردد. زیرا این اسید توانایی حل کردن تمامی فلزات به غیر از طلا را دارا می باشد. از این اسید برای بازیافت زبالههای فلزی یا ضایعات کامپیوتری نیز استفاده میشود.

نیتریک اسید زمانی که در مقابل نور یا حرارت قرار بگیرد، ممکن است تجزیه شود. به همین دلیل است که معمولا این اسید را در ظرفهای تیره رنگ نگهداری میکنند. این اسید در صورت تجزیه شدن، تولید گاز NO2 میکند. این گاز به رنگ قرمز است و به همین دلیل است که بخار این اسید معمولا به رنگ قهوهای مایل به قرمز دیده میشود. این بخاطر در واقع نیتروژن دی اکسید است که با این رنگ قابل دیدن است. این رنگ در اثر تجزیه اسید نیتریک به آب، نیتروزن دی اکسید و اکسیژن دیده می شود.
در برخی موارد نیتریک اسید به صورت گازی نیز کاربرد دارد که معمولا دارای مقادیر کمتری از NO2 هست.
نیتریک اسید با فرمول شیمیایی HNO3 درست شده است. این ماده با نام جوهر شوره نیز شناخته می شود. در تصویر زیر ساختار شیمایی این ماده قابل مشاهده است.
کاربردهای اسید نیتریک
از این اسید در تولید نیترات آمونیوم استفاده میشود. نیترات آمونیوم، یکی از انواع کودها است که میتوانید در مقاله “انواع کود شیمیایی” در مورد آن مطالعه بفرمایید. در ادامه به برخی کاربردهای اسید نیتریک در صنایع مختلف اشاره شده است.
اسید نیتریک برای هضم و آماده سازی نمونه های گیاهی استفاده می شود. در این فرآیند نیتریک اسید باعث حذف شدن بخش های آلی گیاه می شود. در نتیجه امکان اندازه گیری عناصر موجود در گیاه را به پژوهشگران می دهد. جدای از کاربرد در آزمایشگاه های خاک و گیاهشناسی، بدلیل مقادیر زیاد نیتروژنی که دارد، میتواند برای ساخت کود نیز مورد استفاده قرار بگیرد. اما عمده کاربرد آن در فرآیند هضم تر است.
اسید نیتریک اسیدی بسیار قوی است که توانایی حل کردن بسیاری از فلزات را دارد. به همین دلیل است که از این اسید در کنار اسید کلریدریک برای ساخت تیزاب سلطانی استفاده میشود. تیزاب با حل کردن فلزات موجود در بردهای الکترونیکی، برای استخراح طلا از بردهای الکترونیکی قدیمی استفاده میشود.
اسید نیتریک در استخراج طلا استفاده شده است. اسید نیتریک در بازیافت ضایعات الکترونیک نیز بسیار کاربرد دارد و یکی از مواد اصلی است.
از اسید نیتریک در سوخت موشک نیز به عنوان اکسید کننده استفاده میشود.
یکی از کاربردهای اصلی و اساسی اسید نیتریک، استفاده برای شست و شو است. این اسید بدلیل خورندگی ای که دارد و اینکه میتواند تعداد زیادی از فلزات را به خوبی در خود حل کند، بسیار گزینه مناسبی برای شست و شو است.
از اسید نیتریک برای انجام آنالیزهای شیمیایی نیز به کرات استفاده میشود. به عنوان مثال، برای آماده سازی نمونه آنالیزهای ICP-MS و ICP-AES از این اسید استفاده میشود.
از اسید نیتریک برای تولید مواد منفجره، تولید رنگ، تولید دارو و به عنوان یک واکنشگر در خیلی فرآیندها استفاده میشود.
نیتریک اسید در ساخت و تولید پتاسیم نیترات استفاده میشود. پتاسیم نیترات یک افزودنی مواد غذایی و عامل رنگزا است. این ماده به عنوان نگهدارنده برای نگهداری گوشت ها و فرآورده های نمکی استفاده میشود. (مانند سوسیس و کالباس)
بهترین روش برای تولید اسید نیتریک که با هزینه کمی انجام شود و به صورت صنعتی نیز کاربرد داشته باشد، استفاده از آمونیاک به عنوان پیشماده است. در این فرآیند آمونیاک تحت واکنش اکسیداسیون کاتالیکی تهیه میشود. این واکنش در دمایی در حدود 150 تا 170 درجه سانتی گراد انجام میشود. در این روش اسید نیتریک تولید شده غلظتی در حدود 95 درصد دارد. در این روش اسید نیتریک از طریق واکنشهای زیر تولید میشود:
4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (g)
2 NO (g) + O2 (g) → 2 NO2 (g)
3 NO2 (g) + H2O (l) → 2 HNO3
4 NO2 (g) + O2 (g) + 2 H2O (l) → 4 HNO3 (aq)
توضیح فرآیند بالا به این صورت است که گاز آمونیاک در ابتدا اکسید می شود و منجر به تولید نیتریک اکسید و نیتروژن دی اکسید میشود. در ادامه تمامی نیتریک اکسید به دی اکسید نیتروژن تبدیل شده و نیتروژن دی اکسید جذب آب میشود که منجر به شکل گیری اسید نیتریک می شود.
نمونههای صنعتی این ماده معمولا به صورت ترکیب با آب در غلظت 68% موجود هستند. این محلول اگر به صورت خالص باشد، بی رنگ است. (معمولا وجود برخی ناخالصی در داخل آن منجر به تغییر رنگ جزیی محلول می شود که این تغییر رنگ معمولا به سمت زرد است)
همانطور که گفته شد، این اسید در اثر گرما یا نور تجربه می شود. واکنش تجزیه آن به صورت زیر است:
4 HNO3 → 2 H2O + 4 NO2 + O2
این واکنش تحزیه، باعث تولید گاز و تغییراتی در فشار اطراف مایع خواهد شد. نیتروژن اکسید تولید شده در اثر تجزیه، به صورت محلول باقی مانده و باعث تبدیل رنگ آن به زرد یا قرمز می شود. نیتریک اسید خالص در اثر قرارگیری در مجاورت هوا تولید کف سفیدرنگ میکند، در حالی که اگر نیتروژن اکسید در آن حل شده باشد، تولید کف قرمزرنگ مایل به قهوهای خواهد کرد.
اسید نیتریک غلیظ، یک اکسیدکننده قوی است و در ترکیب با مواد سوختنی، انواع الکلها یا مواد احیاکننده و ترکیبات قابل احتراق تولید گرما کرده و یا بسوزد و منفجر شود.
این ماده بسیار خورنده است و باید حین کارکردن با آن، جوانب احتیاط را در نظر گرفت. در صورت بالا رفتن حرارت بسیار زیاد آن، گازهای خورنده و سمی نیز از ماده ترشح میشود.
این ماده در صورت ورود از مجاری تنفسی یا چشمها، بسیار خطرناک است.
 در ویدئو زیر (به زبان انگلیسی) بخارات نیتریک اسید دیده میشود و برخی توضیحات ایمنی مربوط به کار با اسید نیتریک آورده شده است.
در ویدئو زیر (به زبان انگلیسی) بخارات نیتریک اسید دیده میشود و برخی توضیحات ایمنی مربوط به کار با اسید نیتریک آورده شده است.
در مقاله پیش رو قصد داریم به معرفی دسیکاتور و انواع آن و روش کار با آن بپردازیم. دسیکاتور وسیله ایست(معمولا شیشه ای) درپوش دار و برای خشک نگه داشتن و یا خشک کردن مواد از آن استفاده می شود. فروشگاه تماد کالا این امکان را فراهم کرده است تا از خدمات خرید دسیکاتور استفاده کنید. خرید […]
تصویربرداری XPS از ترکیب ها طیف سنجی فوتوالکترونی پرتو ایکس و طیف سنجی الکترونی اوژه را همچنین میتوان برای آنالیز توزیع عنصرهای شیمیایی روی سطوح از طریق تولید نقشه های ترکیب، همانند میکروسکوپ الکترونی مورد استفاده قرار داد. نقشه های ترکیب بیشتر از طریق روبش سطح نمونه با پرتوهای متمرکز به دست میآیند. قدرت تفکیک […]
در این مقاله به معرفی جنس و برندهای ظروف آزمایشگاهی خواهیم پرداخت و اطلاعاتی در این حوزه در اختیارتان قرار میدهیم. ظروف آزمایشگاهی معمولا در دو دسته پلاستیکی و شیشه ای هستند که ظروف شیشه ای استفاده بیشتری دارند. شفافیت، مقاومت گرمایی، دوام، امکان شستشوی آسان و قابلیت استریل کردن، باعث شده که استفاده ظروف […]
دماسنج(تب سنج) ها همانطور که از اسمشان پیداست، دمای جسم یا فقط سطح جسم را به ما اعلام میکنند. دماسنج ها به روش های گوناگونی دما را به ما اعلام میکنند که این گوناگونی باعث پدید آمدن انواع مختلف دماسنج شده است که ما در ادامه به یکی از آن ها یعنی دماسنج مادون قرمز […]