اسید نیتریک یک ترکیب شیمیایی با فرمول HNO3 و جرم مولکولی 63.01g/mol است. اسید نیتریک قابلیتی اسیدیته بسیار بالایی دارد و برای همین از قابلیت انحلال آن در صنعت استفاده فراوانی میشود. نام های دیگر اسید نیتریک، جوهر شوره و تیزاب است. اسید نیتریک خالص مایعی بی رنگ حساس به نور است که به مرور زمان تجزیه شده به اکسید های نیتروژن تبدیل میشود و در نهایت به رنگ زرد تا قرمز تغییر رنگ میکند.
خرید انواع اسید نیتریک
از دیگر ویژگی های جالب اسید نیتریک این است که میزان کم آن قابلیت خوراکی دارد. اسید نیتریک در آب قابلیت انحلال دارد و ph نزدیک به 1 ایجاد میکند که نشان دهنده قدرت اسیدیته آن است. ساختار مولکولی اسید نیتریک به صورت زیر است:
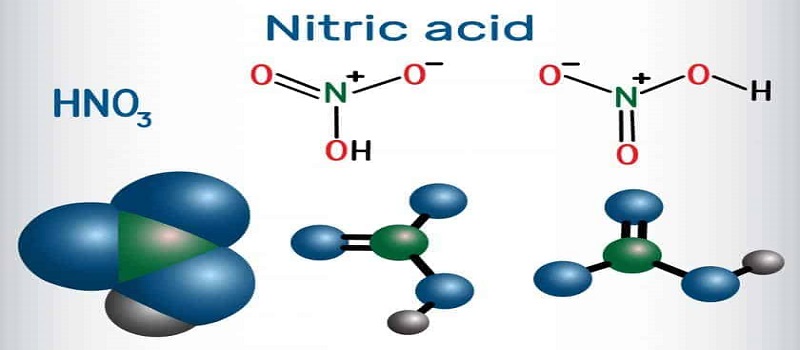
| فرمول شیمیایی | H۱N۱O۳ | شکل ظاهری(دمای اتاق) | Colorless liquid |
| جرم مولی | 63.01 g/mol | انحلال پذیری | Completely miscible |
| چگالی | 1.5129 g/cm3 | ضریب شکست | 1.397 (16.5 °C) |
| دمای ذوب | -42 °C | گشتاور دو قطبی | 2.17 ± 0.02 D |
| دمای جوش | 83 °C | Cas No | 7697-37-2 |
امروزه اسید نیتریک از طریق فرایند استوالد، از اکسیداسیون آمونیاک در هوا و با حضور کاتایزور پلاتین در دمای 900 درجه سانتی گراد بدست می آید.
NH۳ (g) + ۵O۲ (g) → ۴ NO(g) + ۶ H۲O (g)
اکسید نیتریک بدست آمده از واکنش قبلی مجددا اکسید شده و دی اکسید نیتروژن را تشکیل می دهد.
NO (g) + O۲ (g) → ۲NO۲ (g)
در مرحله بعدی دی اکسید نیتروژن با آب ترکیب و منجر به تولید اسید نیتریک می شود.
NO۲ (g) + H۲O (l) → ۲ HNO۳ (aq) + NO (g)
یکی دیگر از روش های تولید اسید نیتریک استفاده از گاز اسید سولفوریک به جای هوا است. برای تولید اسید نیتریک با این روش نیاز به کوره هایی با دمای 150 تا 170 درجه سانتی گراد است. که برخلاف روش قبل گران تر بوده و به انرژی کمتری مورد نیاز است.
اسید نیتریک از طریق روش بریک لند نیز می توان تهیه کرد. در این روش از گاز اکسیژن و نیتروژن استفاده می شود. اما با توجه به کم بودن غلظت اکسید نیتروژن و میزان انرژی بالای الکتریکی مورد نیاز، هزینه بر بوده و امکان برگشت واکنش در دمای بالا وجود دارد.
اسید نیتریک کاربرد های فراوانی دارد که به صورت مختصر به آن میپردازیم اگر می خواهید اطلاعات جامع تری در خصوص کاربرد این ماده بدست آورید به بخش خواص و کاربردهای اسید نیتریک مراجعه کنید.
کاربرد اسید نیتریک در صنعت کشاورزی
در حال حاظر، بیشترین کاربرد اسید نیتریک ساخت کود های شمیایی کشاورزی است. اسید نیتریک به خاطر داشتن نیتروژن در ترکیب خود، دارای امتیاز ویژه ای برای تولید کود است و همچنین به دلیل داشتن خاصیت اسیدی، باعث سمزدای و دفع آفات میشود.
یکی دیگر از کاربرد های اسید نیتریک در صنعت کشاورزی تولید نیترات آمونیوم است. نیترات آمونیوم نیز یکی از مواد مهم در تولید کود های شیمیایی است.
کاربرد اسید نیتریک در تولید حلال
همانطور که گفته شد، اسید نیتریک خاصیت اسیدیته بالایی دارد به خاطر همین قادر است بسیاری از مواد را در خود حل کند. برای همین اسید نیتریک در ساخت بسیاری از حلال های صنعتی کاربرد دارد.
همچنین میتوان از برای خنثی سازی محیط های قلیایی نیز استفاده شود.
اسید نیتریک تنها حلالی است که قادر به حل کردن مس و نقره است، و از طرفی این اسید توانایی حل کردن طلا و پلاتین را ندارد. برای همین در وسایل الکترونیکی که از طلا استفاده شده است، مس و نقره آن را با اسید نتریک جدا میکنند و طلای آن باقی میماند.
دیگر کاربرد های آن به صورت خلاصه در زیر آمده است:
همانطور که گفته شد، اسید نیتریک یک اسیدی بسیار قوی و صنعتی است که مصرف آن در تمام صنایع به وضوح دیده میشود. برای همین، باید نکات ایمنی کار با آن را یاد گرفته و عملی کنیم. در ادامه به نکات ایمنی کار با اسید نیتریک میپردازیم:
آتش سوزی : اسید نیتریک قابلیت اشتعال کمی دارد ولی در صورت ایجاد گرما و جرقه، آتش میگیرد. پس باید در جای خنکی نگداری شود و دور از مواد آتش زا باشد.
خاصیت اسیدی بالا : همانطور که گفته شد، اسید نیتریک ph نزدیک به 1 دارد و خاصیت اسیدیته آن به قدری بالا است که لمس آن باعث ایجاد خطرات جبران ناپذیری خواهد شد. این ماده باید در ظرف مخصوص نگهداری شود که علاوه بر جنس آن، باید درب ظرف نیز سفت و محکم باشد تا از آن لبریز نوشد یا گاز درون آن خارج نشود.
تماس با چشم : تماس اسید نیتریک با چشم منجر به نابینایی میشود مگر اینکه درصد کمی از آن به چشم ما خورده باشد. در صورت تماس آن با چشم باید به مدت 20 الی 30 دقیقه چشم را با آب گرم بشوریم و سپس به پزشک مراجعه کنیم.
تماس با پوست : تماس میزان کمی از اسید نیتریک با پوست دست منجر به ایجاد لک های زرد و قهوه ای خواهد شد و حتی باعث ایجاد زخم های عمقی و دردناکی روی دست میشود که اثر باقی خواهد ماند. در صورت ریختن این اسید بر روی پوست( به میزان کم و متوسط ) باید فوران با آب گرم ناحیه صدمه دیده را 20 الی 30 دقیقه آب بکشید. اگر میزان تماس آن با پوست دست زیاد باشد، هرگز فوران آب بر روی آن نگیرید زیرا باعث مرگ میشود.
خوردن : خوردن اسید نیتریک باعث ایجاد دل درد، تهوع، بیهوشی و حتی مرگ میشود. اگر فردی به این خطر دچار شد، به هیچ وجه به اون چیزی جز آب ندهید. میزان آب نیز باید کم باید و در حدود 300 میلی لیتر باشد و سپس سریعا به پزشک مراجعه شود.
استنشاق : باعث بروز سرگیجه و ایجاد مشکلات تنفسی و حتی قلبی میشود. فردی که با استنشاق گاز اسید نیتریک دچار مصمومیت شود، باید سریعا به فضای باز برود و از کپسول اکسیژن استفاده کند. حواستان باشد که فرد مصموم باید به طور منظم ضربان قلب آن چک شود و در صورت کاهش ضربان آن به بخش اورژانس سریعا مراجعه شود.
نگهداری : باید رد ظروف مخصوص مانند استنلس استیل و یا آلومینیمی و شیشهای نگهداری شود و همچنین فضای اطراف سیمانی باشد. در نزدیکی آن فلز یا مواد قلیایی نباشد و همچنین روی ظرف آن برچسب CORROSIVE-OXIDEZER-POISON زده شود.
در هنگام کار با اسید نیتریک، استفاده از ماسک فیلتر دار، عینک مخصوص، دستکش ساق دار و روپوش بلند الزامی است. رعایت نکردن هر کدام از موارد بالا باعث بروز مشکلات جبران ناپذیری خواهد شد.
در این بخش، به سوالات متداولی که بیشتر درباره اسید نیتریک پرسیده شده است میپردازیم :
نام های دیگر اسید نیتریک چیست؟
نام های دیگر اسید نیتریک،نیترات هیدروژن یا هیدروژن نیترات، ازوتیک اسید، جوهر شوره، اسید ازوتیک، تیزاب، اسید ازته و نیتروکسید آنیل است.
اسید نیتریک را از کجا تهیه کنیم؟
شرکت اینترنتی تماد کالا فعال در زمینه فروش مواد شیمیایی صنعتی و آزمایشگاهی، آماده ارائه خدمات در حوزه فروش اسید نیتریک با کیفیت عالی، قیمت مناسب و در مقادیر دلخواه به مشتریان می باشد. شما میتوانید برای تهیه انواع اسید نیتریک با برند ها و حجم های مختلف، به سایت تمادکالا مراجعه کنید و یا بر روی لینک پیوست شده در قسمت زیر کلیک کنید.

تجزیه اسید نیتریک به چه شکل است؟
اسید نیتریک در دمای اتاق(25 درجه سانتی گراد) تجزیه بسیار کم و ناچیزی دارد که میتوان آن را نادیده گرفت ولی در صورت گرم شدن و قرار گرفتن در معرض مستقیم آفتاب، سرعت تجزیه آن بیشتر میشود و رنگ آن تغییر میکند و قرمز یا زرد رنگ میشود.
واکنش اسید نیتریک با طلا و پلاتین
اسید نیتریک به دلیل خاصیت اسیدیته بالایی که دارد، با تمام فلزات واکن میدهد، ولی تنها دو فلز هستند که با اسید نیتریک واکنش نمیدهند که آن دو فلز طلا و پلاتین هستن که از قوی ترین و نجیب ترین فلزات هستند. به خاطر همین در استخراج طلا از مدارهای الکترونیکی، از اسید نیتریک برای حل کردن سایر فلزات اطراف سیم های طلا استفاده میکنند و در نهایت سین های طلا به صورت جامد در محلول باقی میمانند.
چگونه عیار طلا را با اسید نیتریک تشخیص میدهند؟
در جواهراتی که از طلا استفاده شده است، معمولا طلا خالص نیست و با مس و نقره آلیاژ شده است. همانطور که در قسمت بالا گفته شد، اسید نیتریک با تمام فزات بجز طلا و پلاتین واکنش میدهد. پس اگر جواهر ما از آلیاژ طلا ساخته شده باشد، هرچه میزان طلای آن در آلیاژ بیشتر باشد، واکنش آن با اسید نیتریک کمتر است و هرچه آلیاژ ما ناخاصی بیشتر داشته باشد، واکنش آن سریع تر و واضح تر است.
آب اکسیژنه برای اولین بار توسط آقای تنارد شناسایی شد. او با اسیدی کردن پراکسید باریم و خارج نمودن آب اضافی آن، از طریق تبخیر در خلأ، موفق شد این محلول را اختراع نماید. آب اکسیژنه محلولی بی رنگ است که از نظر خواص فیزیکی بسیار مشابه آب بوده اما خواص شیمیایی فراوانی دارد. میزان […]
تفسیر طیف های ارتعاشی مولکولی (FTIR و رامان) کار ساده ای نیست. این کار مستلزم دانش نظریه تقارن و نظریه ریاضی گروه است تا به وسیله آن بتوان همه نوارهای ارتعاشی طیف را به طور دقیق بررسی کرد. برای کاربردهای طیف سنجی ارتعاشی جهت تعیین مشخصات مواد، می توان طیف های ارتعاشی را با روش […]
اگر در آزمایشگاه کار می کنید و یا در حال گذراندن کلاس های آزمایشگاهی هستید، با انواع مختلفی از ظروف شیشه ای رو به رو خواهید شد که هر یک دارای ویژگی های خاصی می باشد. دانستن تفاوت بین انواع ظروف شیشه ای به شما کمک می کند که آزمایشات را با کارایی بیشتری طراحی […]
کورهها یکی از تجهیزات بسیار پرکاربرد در لابراتوارهای دندان پزشکی هستند. در مقاله پیش قصد معرفی این کورها و کاربردهای آنها در دندان پزشکی را داریم. فروش کوره آزمایشگاهی کوره های دندان سازی در ترمیم دندان ها و بسیاری از فرآیندهای مختلف، از سرامیک ها استفاده می شود. سرامیک ها برای شکل گیری و سفت […]